溶出度测试:开始前需要了解的一切
2024-12-17
明确溶出度测试的动机可确保为测试方法开发奠定最坚实的基础。那么,让我们仔细看看它的相关性和关键性。
在研究身体如何与给药药物相互作用时——药代动力学 (PK)——关键过程是吸收、分布、代谢和排泄 (ADME)。这些定义了药物如何进入、穿过和离开身体,以及在体内建立 的药物浓度,该浓度受到控制以实现临床疗效并避免毒性。对于 OSD,崩解和溶解是该机制链中的第一步,驱动步骤,因为吸收依赖于药物从其递送形式中释放和随后的溶剂化。以这种方式,溶出行为会影响生物利用度、药物具有治疗效果的能力,进而影响毒性风险。因此,测量溶出行为是获得有关药物性能、性能一致性和安全性的宝贵见解的最简单方法之一。
也就是说,重要的是要认识到吸收不仅仅受解散的支配。通常,通过胃肠道细胞膜的通透性同样重要,这反映在生物药剂学分类系统 (BCS) 中,该系统根据溶解度和通透性对药物进行组合分组(见下文)。
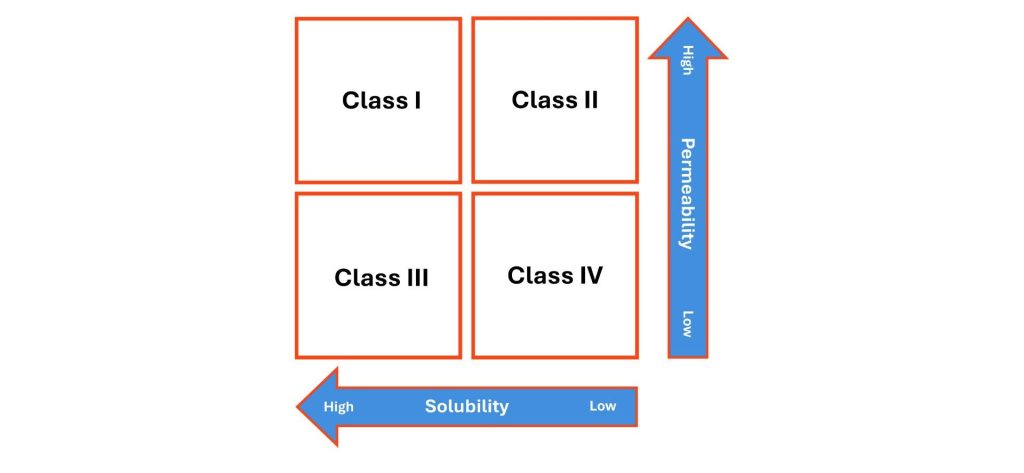
I 类和 II 类药物具有高渗透性,因此一旦溶解,就会相对容易地进入循环。对于目前在药物开发管道中占主导地位的 II 类药物,这意味着生物利用度可能会受到溶出速率的限制。BCS II 类药物近年来一直是溶解度增强研究的重点,并且已经开发了针对此类化合物的几种配方方法。
相比之下,III 类和 IV 类药物由于渗透性差,即使溶解也不容易吸收。对于这些药物,药物浓度有可能在膜的“递送”侧变得相对较高,而在血液中保持非常低。
另外,请注意在底部轴上使用了术语溶解度。当谈到溶出行为时,我们可以研究溶出速度和药物在不同介质中的溶解程度。两者都很重要。
我们如何使用溶出度测试数据?
从溶出度研究中获得的数据推动了整个配方的选择和进展,有助于根据 API(活性药物成分)、赋形剂、配方和制造策略提高生物利用度的能力来区分它们。这些数据还支持日益复杂的 PK 建模,以有效地加速药物上市,并有助于在药物的整个生命周期内保护质量,直到仿制药开发和向非处方药供应的任何过渡。
让我们通过考虑它们可以帮助回答的问题来更详细地研究溶出度数据的使用,这些问题包括:
- 哪种形式的药物更适合用于速效产品?
- 是否有空间通过改变 API 的制造路线来控制颗粒大小或形状等特性来改善溶出特性?
- 我能否鉴定出可以提高溶解速率或增加溶解度的辅料?溶出过程中是否释放了所有药物?
- 哪些辅料在溶出性能方面最有利?哪些是有害的?
- 这种包被或基质能否实现药物的持续释放?药物释放曲线是否最适合临床疗效?
- 压片条件(如压实压力)和片剂特性(如硬度)如何影响溶出行为?
- API 或辅料供应的变化是否影响了溶出度曲线?
- 该测试产品是否提供与参比相同的溶出度曲线?
- 这批片剂是否相当于十年前上周、上个月、上批的那批片剂?
这些问题说明了溶出度测试数据应用的广度,以及需要仔细考虑测试方法以优化其解决不同问题的能力。
溶出度测试方法受哪些因素影响?
USP 溶出度法 1(篮子 – 左)和法 2(桨形 – 右)是最常见的溶出度测试设置。在以后的博客中,我们将更详细地介绍与这些和其他五种药典溶出度测试仪相关的测试方法。不过,在这里,我们想强调与测试方法相关的一些更广泛的要点。

首先,很明显,需要决定所使用的溶出介质,是模拟进食还是禁食状态,例如,是否修改溶出介质的 pH 值或其他方面以反映胃肠道不同区域的溶出度,和/或用于代表性测试的适当搅动水平。
其次,存在局部药物浓度的问题。溶出度测试设备体积相对较大,这意味着测试往往在 “下沉 ”条件下进行,换句话说,在将局部药物浓度保持在如此低的水平,以至于对溶出行为没有影响的条件下进行。这可能是首选项。但是,如果在实践中药物必然会溶解成相对浓缩的溶液,例如,因为目标是缓释,或者因为渗透性差(3 类和 4 类药物),那么替代策略可以说更相关。
第三,II 类候选药物数量的增加加剧了对灵敏溶出度测试的需求。大检测量与微溶性药物相结合,意味着需要测量极低浓度的药物,这具有挑战性的分析方法。减少测试量可能会缓解这个问题,并且有 现成的解决方案 可以做到这一点,但更普遍地说,此类测试需要提高设备和方法的精度。
最后但并非最不重要的一点是,溶出度测试数据的广泛适用性和价值凸显了高效测试设置和方法的重要性。因此,投资使 溶出尽可能准确、高效和简化的设备 是非常值得的。
结论
溶出度测试方法已经成熟,但会根据测试具有挑战性的候选药物和日益复杂的 OSD 产品的要求不断发展。明确测试的目的对于确保测试设置和方法尽可能相关至关重要。如果您有兴趣了解更多关于溶出度测试的基础知识,那么我们有一篇很棒的 介绍性文章;或者,请留意未来的博客,届时我们将更详细地研究测试的实用性。






